Farmaci equivalenti e Ricerca e Sviluppo: in che modo Teva produce e distribuisce il più ampio portfolio di farmaci al mondo

I farmaci equivalenti sono una parte essenziale dell'assistenza sanitaria moderna. Spieghiamo il perché e diamo uno sguardo alla Ricerca, ai processi di Sviluppo e alle sfide relative alla loro creazione.
La maggior parte di noi assumerà probabilmente un farmaco equivalente 01 nel corso della propria vita. Nel 2021, le vendite globali di farmaci equivalenti da prescrizione hanno raggiunto gli 82 miliardi di dollari 02. Entro il 2026, si prevede che il mercato varrà 99 miliardi di dollari 03. Ma cosa sono?
I farmaci equivalenti nascono per essere alternative ai farmaci originatori il cui brevetto è scaduto. Devono superare rigidi test di sicurezza, qualità ed efficacia. I farmaci equivalenti hanno gli stessi principi attivi e hanno la stessa efficacia clinica dei farmaci originatori.
"Molti pensano che i farmaci equivalenti siano diversi dai farmaci originatori ma non lo sono", spiega Michael Banks, Senior VP Global Regulatory Affairs di Teva. “È per questo che il processo di approvazione è così importante, infatti gli enti regolatori competenti devono accertare l’equivalenza di questi medicinali a quelli già presenti sul mercato”.
Il grande vantaggio dei farmaci equivalenti è che possono essere significativamente meno costosi da produrre rispetto ai farmaci originatori non più protetti da brevetto. Ciò vuol dire che i farmaci equivalenti possono essere sviluppati a un costo inferiore e quindi venduti a un prezzo molto più basso rispetto ai farmaci originatori, consentendo così a più persone di avere accesso ai farmaci di cui hanno bisogno.
“I farmaci equivalenti consentono un migliore accesso all'assistenza sanitaria a livello globale. Essi sono un bene necessario per tutti”, afferma Michael Banks.
Farmaci equivalenti: aumentano l’accesso alle cure per i pazienti
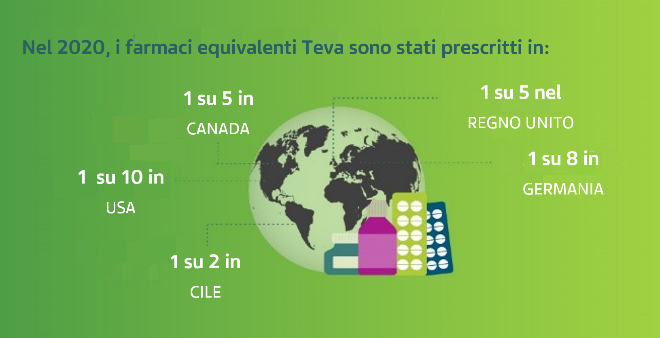
Quasi 200 milioni di persone in tutto il mondo utilizzano un prodotto Teva ogni giorno. Nel 2020, i farmaci equivalenti Teva prescritti sono stati 1 su 10 negli Stati Uniti, 1 su 5 in Canada, 1 su 8 in Germania, 1 su 5 nel Regno Unito e 1 su 2 in Cile.
In Teva ci impegniamo a garantire l'accesso all'assistenza sanitaria ed è per questo che investiamo una parte significativa del nostro budget di Ricerca e Sviluppo nei farmaci equivalenti. Nel 2020, Teva ha investito quasi 1 miliardo di dollari in attività di Ricerca e Sviluppo, con più di 1.160 farmaci equivalenti nella sua pipeline di prodotti in sviluppo.
Questo investimento fa sì che i pazienti in tutto il mondo abbiano un accesso sostenibile ai farmaci.
Dietro le quinte: cosa serve per produrre il più ampio portfolio di farmaci al mondo?
Dalla Ricerca e Sviluppo agli studi clinici, dalla produzione, all'approvazione, all’immissione in commercio, ogni giorno 40.000 dipendenti Teva in tutto il mondo aiutano a fornire farmaci indispensabili alle persone che ne hanno bisogno.
Di solito si pensa alla Ricerca e Sviluppo solo pensando ai farmaci specialistici, per l’attività di ricerca e preparazione di nuove molecole. Ma è necessaria una grande quantità di Ricerca e Sviluppo anche per produrre i farmaci equivalenti.
Perché?
Perché produrre una versione equivalente di un farmaco in modo che funzioni allo stesso modo, con lo stesso effetto terapeutico, la stessa forma farmaceutica e lo stesso dosaggio, utilizzando i medesimi principi attivi dei farmaci originatori, è piuttosto difficile. Ci vogliono molta ricerca, innovazione e conoscenze specialistiche per produrre farmaci equivalenti.

Potresti pensarla così: trasformare un farmaco di marca in un farmaco equivalente è come ottenere una ricetta per un piatto che non hai mai preparato prima. Immagina di avere la ricetta, ma non puoi usare gli stessi ingredienti e devi riuscire a riprodurre esattamente gusto, dimensione, consistenza e calorie presenti nella ricetta. Come si fa? Questo è ciò che scopre il nostro team di Ricerca e Sviluppo.
La Ricerca e Sviluppo di Teva utilizza l’approccio "Quality by Design" nella progettazione, nello sviluppo e nella produzione dei suoi prodotti. Questo approccio mira a garantire la qualità impiegando metodologie statistiche, analitiche e di gestione del rischio nella progettazione, sviluppo e produzione dei farmaci. 04
“L’approccio "Quality by Design” garantisce che ognuno di quei 200 milioni di pazienti che assumono i nostri farmaci equivalenti, riceva un prodotto di qualità", afferma Parag Shah, Senior Director and Site Head di Teva Pharmaceuticals.
"Nel nostro centro di Ricerca e Sviluppo lavoriamo su circa 40-50 prodotti in pipeline contemporaneamente. Tutti sono in fasi differenti: dalla valutazione alla fase intermedia fino al quasi completamento. Il nostro programma di Ricerca & Sviluppo si basa su qualità e sicurezza, garantendo che ogni farmaco rispetti questi criteri”.
Il team di Ricerca e Sviluppo di Teva sviluppa farmaci equivalenti di qualità che possiedono la stessa efficacia terapeutica dei farmaci originatori presenti a mercato. Aggiunge Parag Shah: "Il nostro team ha la responsabilità di sviluppare un prodotto che sia buono quanto il farmaco originatore o, in alcuni casi, anche migliore".
Un rigoroso controllo qualità è essenziale
Teva svolge i suoi processi di Ricerca e Sviluppo eseguendo test approfonditi, tra cui quelli volti ad assicurarsi che il dosaggio abbia la stessa efficacia del farmaco originatore, e i test "in vivo", confrontando le sue prestazioni complessive rispetto al farmaco originatore. I test "in vivo" vengono eseguiti su organismi viventi, come esseri umani, piante o cellule.
Rigorosi test di "stabilità" durante la fase di Ricerca e Sviluppo assicurano che l’efficacia del medicinale sia stabile e che rimanga inalterata per tutto il suo periodo di validità.
Un altro ostacolo da superare per un farmaco equivalente è dimostrare la "bioequivalenza" con il farmaco di marca. La bioequivalenza è un dato che tiene conto di una serie di fattori, tra cui quanto strettamente due farmaci con lo stesso principio attivo producono gli stessi risultati clinici e se il farmaco originatore e il farmaco equivalente vengono assorbiti dall'organismo del paziente a una velocità simile.
Beth Rody è Senior Director, Generic Clinical R&D di Teva Pharmaceuticals. Il suo team supporta la maggior parte dei siti di sviluppo di Teva. "Siamo responsabili degli studi di bioequivalenza necessari per l'approvazione dei farmaci equivalenti".
“Teva conduce in genere circa 150 studi di bioequivalenza in un anno per i mercati globali, sebbene il numero sia stato inferiore nel 2020 a causa della pandemia di Covid-19”, aggiunge Beth Rody.
In che modo Teva può garantire che un farmaco equivalente sia bioequivalente rispetto all’originatore? Beth Rody e i suoi colleghi esaminano le informazioni pubbliche disponibili sul farmaco originatore e anche le linee guida specifiche del prodotto fornite dall'ente regolatorio. "Cerchiamo informazioni sulla farmacocinetica del farmaco per progettarne lo studio", afferma. La farmacocinetica è lo studio dell’assorbimento, della distribuzione, del metabolismo e dell’eliminazione del farmaco: Beth Rody e il suo team sono responsabili di questo studio, e devono assicurarsi che la struttura dello studio di bioequivalenza sia appropriata.

Teva è impegnata ad aumentare l’accesso a farmaci sostenibili di qualità a quanti più pazienti in tutto il mondo. I nostri scienziati stanno sviluppando farmaci equivalenti che hanno l’obiettivo di aumentare l'accesso ai trattamenti che possono migliorare la salute dei pazienti e far risparmiare miliardi di dollari ai sistemi sanitari. Teva continua a impegnarsi nella sua missione per aiutare le persone a migliorare la propria salute.

